

COULEUR ET MINÉRAUX - 1
La lumière

Fluorite multicolore.
Erzgebirge, Allemagne.
Photo : Cristal and Mineral.

LA LUMIÈRE & LA COULEUR
Pour la plupart des gemmes et des minéraux, le caractère le plus évident ou l’aspect qui frappe le plus immédiatement l’observateur est la couleur. Les causes de coloration des minéraux sont multiples et la complexité des théories permettant leur étude ne facilite pas la transmission des connaissances sur ce sujet.
La couleur des minéraux est importante lors de leur détermination.
Question : d’où vient la couleur des minéraux ?
Pour bien comprendre les phénomènes physiques liés à la couleur il faut d’abord connaître l’origine de la couleur, c'est-à-dire la lumière.
LA LUMIÈRE
La lumière est un mouvement ondulatoire ou vibratoire qui se caractérise par des paramètres : la longueur, la fréquence, l’amplitude, la célérité.

Longueur
La longueur est la distance séparant deux maximas successifs, on l'exprime en nanomètres*. Elle varie en fonction de la couleur.
Fréquence
La fréquence est le nombre d’oscillations par seconde.
Amplitude
L’amplitude est fonction de l'intensité lumineuse; la lumière de forte intensité est de grande amplitude, celle de faible intensité est de petite amplitude.
Célérité
Plutôt que de parler de vitesse, puisqu'il n'y pas de transport de matière mais d'énergie, on parle de célérité. Celle-ci s'écrit "c" , elle est égale à :
* nanomètre = milliardième de mètre (0,000 000 001m ) soit millionième de millimètre (0,000 001mm)
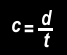
d est la distance (mm, ..., km) parcourue pendant une durée t (s, ..., h)
Pour la lumière, dans le vide, sa célérité est de 299 792.458 km.s-1 (prononcer kilomètres par secondes) que l'on arrondit à 300 000 km.s-1 le plus souvent dans le langage populaire.
Dans le vide ou dans les gaz et matériaux homogènes, la lumière se propage en ligne droite. Dans la matière, solides, liquides ou gaz, elle se propage moins vite; on dit de ces milieux qu'ils sont dispersifs, la célérité varie selon la couleur de la lumière. Nous reviendrons à cela en étudiant l'indice de réfraction.
LA TEMPERATURE DE LA LUMIERE
C'est une notion qui qualifie la sensation visuelle et sa chromaticité.
Elles s'expriment en degrés Kelvin dans une bande de 1 000 à 11 000°K .

LA LUMIERE VISIBLE
La lumière visible, appelée aussi spectre visible ou spectre optique est la partie du spectre électromagnétique qui est visible pour l'œil humain.

Rappel de chimie ...

Les électrons, particules du type lepton dont la charge électrique est négative. ils forment un nuage électronique autour des noyaux d'atomes.



Les schémas montrant les électrons en orbites autour des noyaux d'atomes sont une simplification.

Les électrons autour d’un atome n’ont pas réellement de position définie. Ils forment une sorte de nuage autour du noyau, et ils sont constamment à tous les endroits à la fois, avec des probabilités bien définies toutefois. On ne peut pas parler de position, ou de quantité de mouvement, pour une particule, mais seulement de densité de probabilité de présence. Ces probabilités sont calculables avec une énorme précision, grâce à l’équation de Schrödinger. Mais on ne peut jamais dire où se trouve un électron à un instant donné.
C'est pourquoi l'on parle d'orbitale plutôt que d'orbite de l'électron, l'orbitale est la distribution de probabilité de position de l'électron. Pour se faire une image, on a calculé des vitesses prodigieuses d'environ 7.1015 (sept millions de milliards) de révolutions par seconde.
Simplification
Un atome peut avoir jusqu'à 7 orbitales d'électrons désignées par les lettres K à Q du niveau inférieur au niveau supérieur.
Chaque orbitale peut recevoir un maximum d'électrons ainsi répartis :
-
K maximum 2
-
L max 8
-
M max 18
-
N max 32
-
O max 32
-
P max 18
-
Q max 8
La couche K est la seule couche électronique commune à tous les éléments. Ainsi, le nombre de couches électroniques d'un atome dépend du nombre d'électrons de cet atome. Mais la capacité des couches électroniques d'un atome ne laisse pas présager de la répartition par couche de ses électrons. En effet, seuls les 18 premiers éléments chimiques du tableau périodique (de l'hydrogène [Z = 1] à l'argon [Z = 18] suivent un remplissage linéaire tendant vers la saturation de leurs couches électroniques (K, L et M).
Les électrons d’un atomes peuvent avoir plusieurs rôles au sein d’une structure d’atomes :
-
électrons de cœur : ceux-ci sont proche du noyau et n’interagissent pas vraiment avec les autres atomes ;
-
électrons de valence : ceux-ci sont sur les couches externes de l’atome et permettent de créer des liaisons interatomiques et de former les molécules ;
-
électrons de conduction : ceux-ci sont responsables de la circulation du courant électrique.


LES PHOTONS
L’onde électromagnétique est la propagation d'un mouvement vibratoire qui se transmet dans les corps, qu’ils soient gazeux, liquides ou solides. Son vecteur est le photon, un élément de la physique très mystérieux.
En 1926 le chimiste Gilbert Newton Lewis baptise les photons que l’on appelait « quanta de lumière » (paquets de lumière) avant lui. Ce sont les travaux de Maxwell (1865), Planck (1900) et Einstein (1905) qui mettent en évidence l’existence des quantas. Maxwell résout les équations fondamentales des forces électromagnétiques, il démontre que le champ électromagnétique vibre et qu’il se propage à la vitesse de 299 792 km/s que l'on arrondi à 300 000 km par seconde. Puis Planck et Einstein complètent ces travaux par le comportement des quantas. Les photons sont les vecteurs de la force électromagnétique, ce sont des particules d’énergie qui n'ont ni masse, ni charge électrique qui se déplacent en ligne droite leur durée est illimitée .
Ce sont des bosons symbolisé par : ɣ.

L'INTERACTION RAYONNEMENT MATÉRIAU

La lumière est un phénomène physique, photoélectrique, elle est due à l’interaction entre photons et électrons.
Les photons émis par une source lumineuse ont un mouvement rectiligne ondulatoire dont la fréquence grandit avec l’énergie.
Les interactions rayonnement-matériau montrent les conséquences d'un rayonnement sur un atome.
Le terme «rayonnement» est à prendre dans son sens quantique :
-
rayonnement électromagnétique (lumière, rayon X, rayon gamma).
-
particule (électron, neutron, rayonnement alpha).

Ces émissions sont utilisées pour observer la matière.
Les atomes étant trop petits pour être perceptibles, on observe la façon dont ils modifient un rayonnement incident.
L’étude du rayonnement incident permet deux types de procédés d'analyse :
-
la diffraction
-
la spectrométrie
Quels sont les différents cas de figures ?
Le rayonnement électromagnétique, photon, incident agit de plusieurs façons sur un atome :
-
la diffusion
-
l'absorption (ionisation)
Il peut rebondir on dit diffuser :
-
Il rebondit sans perte d'énergie, c'est la diffusion "Rayleigh".
-
Il rebondit en provoquant l'éjection d'un électron faiblement lié, il perd donc de l'énergie, c'est la diffusion "Compton".
Il peut être absorbé, ce qui déclenche une transition électronique, c'est-à-dire le passage d’un électron d’un niveau d’énergie à un autre ; l'atome est excité puisque son état d’énergie change. Il en découle une désexcitation : un électron d'une couche supérieure remplace l'électron éjecté.
-
Lorsque l'énergie incidente est faible, cela provoque simplement le changement d'orbite d'un électron .
-
Lorsque l'énergie est modérée, cela provoque une ionisation, on appelle cela un effet photoélectrique et l'électron éjecté est un photoélectron ; la désexcitation induit l'émission d'un photon de faible énergie (visible ou ultra-violet), c'est le phénomène de fluorescence.
-
Lorsque l'énergie est forte, l’ionisation est semblable au cas d’une énergie modérée; la désexcitation induit deux cas de figure :
-
Soit l’émission d’un photon fluorescent de forte énergie, c’est un photon X, c’est la fluorescence X.
-
Soit ce photon X est capturé par l’atome, provoquant ainsi l’éjection d’un électron périphérique, on appelle celà l’émission Auger.


Sur cette animation le photon rebondit sur l'atome sans perdre d'énergie, sous forme de rayonnement électromagnétique, c'est la diffusion Rayleigh.
Sur cette animation, le rayonnement rebondit et produit l'éjection d'un électron de l'orbite électronique extérieure, donc faiblement lié. Il y a perte d'énergie, c'est la diffusion Compton.

Sur cette animation, l'énergie est suffisante pour provoquer une ionisation, c'est à dire l'éjection d'un photoélectron. Lors de la désexcitation, un électron d'une orbite supérieure vient remplacer l'électron éjecté et un photon de faible énergie est émis, phénomène de fluorescence U-V visible.
Ci-dessous l'énergie de transition est élevée, deux cas se présentent :

1- il y a émission d'un photon fluorescent qui par son énergie est un photon X, c'est le phénomène de fluorescence X.

2- le photon X est capturé par l'atome, ce qui provoque l'éjection d'un électron périphérique, c'est l'émission Auger.
L'INDICE DE RÉFRACTION
L'indice de réfraction d'un matériau s'écrit "n" il est défini ainsi :
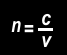
"c" est la célérité de la lumière dans le vide, "v" est la célérité de la lumière dans le matériau.
C'est un nombre positif (>1), puisque "c>v".
Il est fonction de la longueur d'onde de la lumière et du milieu dans laquelle elle se propage.
Plus "n" est grand, plus le matériau est dit réfringent.


Ce tableau montre quelques indices de réfraction
dans différents milieux.
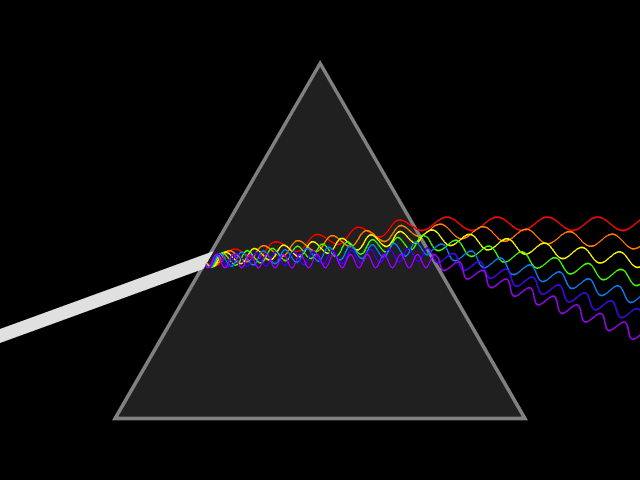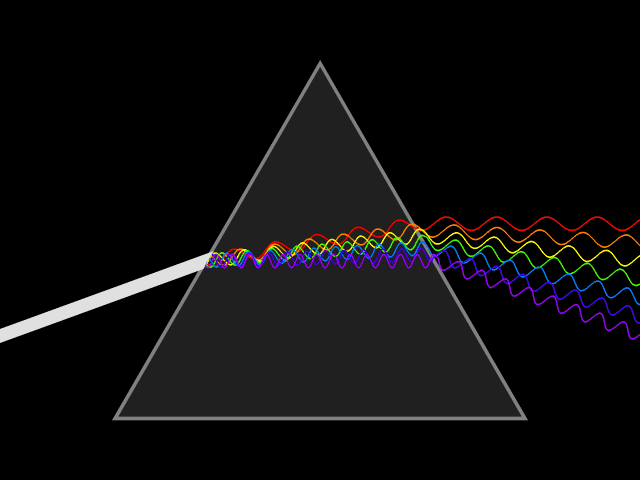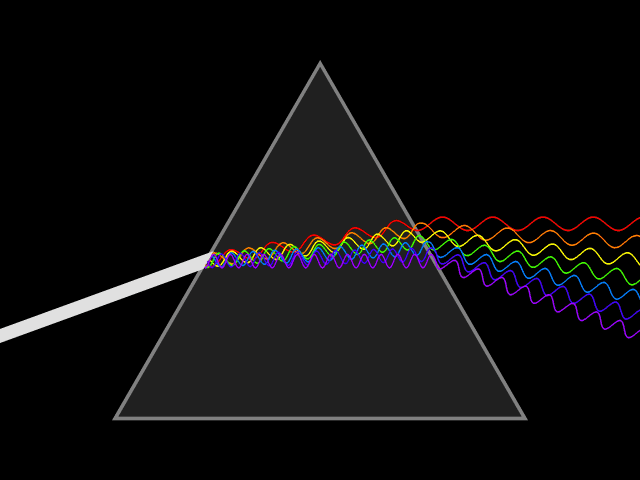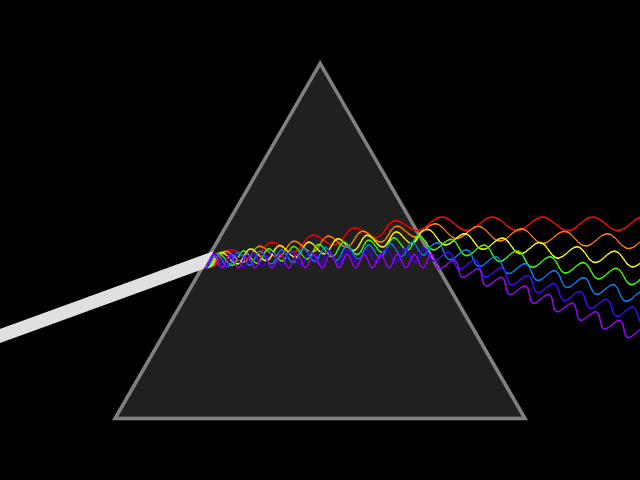
Janvier 1666 ISAAC NEWTON DECOMPOSE LA LUMIERE EN COULEURS.


La vitesse de la lumière ou célérité...
La vitesse de la lumière dans le vide est une constante physique fondamentale dans tout l'univers, que l'on appelle célérité, pour son immatérialité. C'est la vitesse à laquelle le rayonnement électromagnétique se déplace dans le vide communément notée 300 000 kilomètres par seconde
Dès l'antiquité scientifiques et philosophes émettaient des théorie sur état, que certains pensaient variable et d'autres finie.
1629, Isaac Beeckman tente une expérience, puis 1635 c'est Galilée, ce sont des échecs.
C'est en 1676 que Ole Christensen Rømer, astronome danois, de l'Observatoire de Paris, démontre qu'elle est finie, il est lke premier à tenter de la mesurer..
La vitesse calculée précisément est :
299 792 458 mètres par seconde+/- 1m, soit 1 079 252 849 km/h





