




... Suite
ATOMES & ÉLÉMENTS CHIMIQUES
L'Atomisme une histoire ancienne
Il est probable que diverses anciennes civilisations ont supposé l’idée d particules ou grains invisibles composant la matière.
En Inde, la philosophie Vaisheshika, dont Kanada (probablement vers 600 av. J.-C) est le fondateur, contient une théorie atomique. Son traité, les Vaisheshika Sutra, date des premiers siècles de notre ère.
L’atomisme en Inde s’est développé à travers plusieurs écoles bouddhistes et hindouistes, École Nyâya-Vaiśeṣika et École Jaina, chacune caractérisée par ses propres théories philosophiques. L’atomisme, malgré la diversité des différentes perspectives auxquelles il a pu donner lieu, avait comme objectif de rendre compte de l’unité fondamentale qui constitue le monde que nous percevons à travers les sens, cette unité étant l’atome. Le terme sanskrit qui désigne cette particule est aṇu ou paramaṇu. Les diverses écoles qui parlent d’atomes ont diverses conceptions de ceux-ci, mais elles se rejoignent en ce que les atomes ne sont pas directement observables, même à travers des instruments : leur existence est certes déduite à partir de l’expérience, mais comme résultat d’un raisonnement spéculatif qui s’appuie sur celle-ci et supplée à ses limites.
En occident, Mochus de Sidon, un Grec aurait émis la théorie atomiste pour la première fois autour du XIIIe siècle av. J.-C., plus clairement, ce concept apparaît en Grèce environ cinq siècles av. J.-C., chez les philosophes présocratiques, particulièrement Leucippe (environ 460-370 av. J.-C.), Démocrite puis Épicure.
Nombreux sont les atomistes grecs, Nessas, Métrodore de Chios, Diogène de Smyrne, Anaxarque, Hécatée d'Abdère, Apollodore de Cyzique, Nausiphane, Diotime, Bion d'Abdère, Bolos de Mendès.






Lucrèce, un Romain, exposera ensuite de manière exhaustive la théorie atomiste dans son ouvrage « De rerum natura ». Il soutiendra que les corps élémentaires sont […] d’une simplicité impénétrable et forment un ensemble homogène et étroitement uni de particules irréductibles […] dont la nature ne permet pas de retrancher ou de soustraire quoi que ce soit de plus. Un des arguments majeurs développés par les atomistes est la permanence de l'univers qui propose l'existence de choses extrêmement petites et indivisibles rendant nécessaire une certaine quantité d'énergie pour décomposer la matière.
Il s'agit d'une conception du monde qui fait partie de la recherche des principes de la réalité, recherche qui caractérise les premiers philosophes : on suppose que la matière ne peut être divisée indéfiniment, qu'il y a donc une conservation des éléments du monde, qui se transforment ou se combinent selon des processus variés. La décomposition du monde en quatre éléments, eau, air, terre, feu, d'Aristote, enrichi cette thèse. Cependant, même si l'empirisme épicurien tente d'établir cette hypothèse sur des bases scientifiques, l'atome demeure une intuition sans confirmation.
Dans l’Islam médiéval, le kalâm, sous l'impulsion des théologiens mu'tazilites, développe des idées atomistes. La notion d'atome (juz') semble indiquer une connaissance de la pensée grecque par les premiers théologiens de l'islam. L'atomisme musulman a été théorisé par Abû l-Hudhayl. Pour lui, l'atome est dépourvu de dimensions spatiales, comme un point géométrique. Il étend sa conception atomiste au temps, vu comme discontinu ; c'est l'intervention de Dieu qui assure la liaison entre les instants. Cette doctrine est reprise ensuite par le courant asharite.
L'existence des atomes peut sembler paradoxale dans un contexte religieux, parce qu'elle est habituellement associée au matérialisme. Mais, dans la théologie d'al-Ash'ari, les atomes sont les moyens dont Allah se sert pour exercer sa toute-puissance. Ils servent à penser la relation entre un Dieu transcendant et sa création.
Au Moyen Âge, l'atomisme s'illustre au XIVe siècle avec Nicolas d'Autrecourt, Gérard d'Odon, Nicolas Bonet.
Au XVIIe siècle L'atomisme vitaliste de Giordano Bruno double son atomisme d'un vitalisme, dans un poème latin intitulé De minimo, daté de 1591. L'atome est centre de vie, il est un point où vient s'insérer l'Âme du monde. En 1591, à Francfort, Giordano Bruno a écrit en latin deux poèmes sur la monade : De triplici minimo et De monade, numero et figura. Il appelle minimum ou « monade » une entité indivisible qui constitue l'élément minimal des choses matérielles et spirituelles. La monade, qui correspond au point des mathématiques et à l'atome de la physique, est cet être primitif, impérissable de nature aussi bien corporelle que spirituelle, qui engendre, par des rapports réciproques, la vie du monde. C'est une individualisation extrinsèque de la divinité ; existence finie, elle est un aspect de l'essence infinie. Dieu, minimum et maximum, est la Monade suprême d'où s'échappe éternellement une infinité de monades inférieures.
Le corpularisme du XVIIe siècle, sans être forcément atomistes, Galilée, Pierre Gassendi, Sébastien Basson, Robert Boyle et Newton admettent l'existence de petites particules de matière dans la nature.
Galilée publia en 1623 un ouvrage important en matière de philosophie atomiste, L'Essayeur, qui lui valut une lettre de dénonciation du jésuite Orazio Grassi, en raison de thèses contraires au dogme catholique de la transsubstantiation.
Le principal théoricien de l'atomisme au XVIIe siècle fut Pierre Gassendi, chanoine de Digne, qui, après avoir étudié la vie et la doctrine d'Épicure, publia en 1649 les Animadversiones.
En 1646, le Français Johannes Magnenus publia « Democritus reviviscens sive d’atomis » (« Démocrite revivant, ou de l’atome »).
Au XVIIIIe siècle l’essor de la chimie moderne sera le début de la science atomistique débarrassée des théories et contraintes philosophiques.

Le mot « atome », du grec ancien ἄτομος [átomos], « insécable », désigne la plus petite partie d’un corps simple pouvant se combiner chimiquement avec d’autres. Ils sont les composants élémentaires de tous les composés solides, liquides ou gazeux. Avec leur arrangement tridimensionnel, ils déterminent les propriétés physiques et chimiques de tous les éléments et composés .
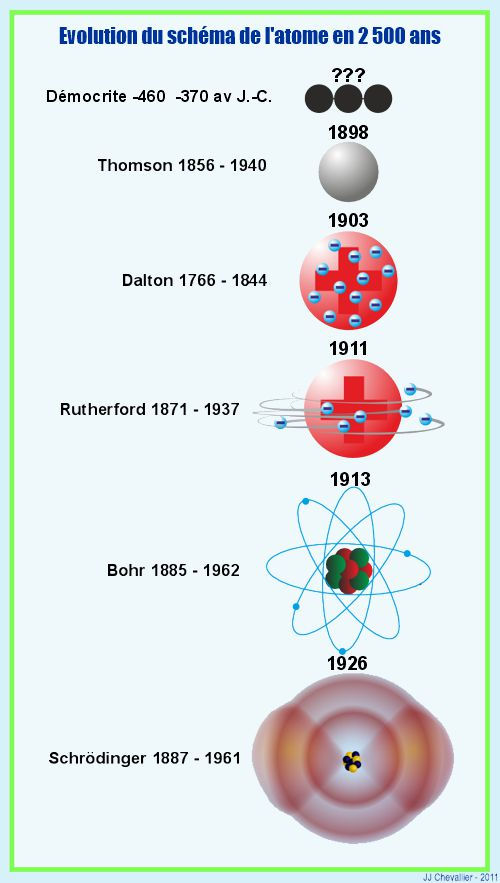
Comme nous l'avons vu sur la page structure de la matière, l'atome est un assemblage de trois sortes de particules :
-
Les protons qui ont une charge électrique positive.
-
Les neutrons qui n'ont pas de charge électrique.
-
Les électrons dont la charge électrique est négative et égale en valeur absolue à celle des protons. Il y a autant d'électrons que de protons dans son noyau c'est pourquoi un atome est électriquement neutre.
Protons et neutrons forment le noyau, les électrons gravitent autour du noyau à des vitesses prodigieuses d'environ 7.1015 (sept millions de milliards) de révolutions par seconde. Cet ensemble de neutrons en orbite autour du noyau forme ce que l'on appelle le nuage électronique.
Définitions importantes à retenir :
Ion : atome ou molécule ayant gagné ou perdu un ou plusieurs électrons, on distingue donc deux types d'ions :
-
Anion : atome ou molécule ayant gagné un ou plusieurs électrons, la charge est alors négative.
-
Cation : atome ou molécule ayant perdu un ou plusieurs électrons, la charge est alors positive.

La structure de 2 atomes, hydrogène et oxygène.
Les neutrons et les protons ont des masses pratiquement identiques, les électrons ayant une masse 2 000 fois moindre que les protons et les neutrons, la somme des protons et neutrons, "nombre de masse", d'un noyau est donc sensiblement égale au "poids atomique".



Les atomes sont très petits, mais leurs noyaux sont encore infiniment plus petits, l'atome est environ 10 000 fois plus gros que son noyau où se trouve pratiquement toute sa masse.
Diamètre d'un atome moyen
1,5 angström = 0,15 nanomètre = 15^-10 mètre
Le plus petit et le plus grand :
-
0,53 Hydrogène H
-
2, 98 Césium Cs
Rayon en angström des éléments chimiques naturels
Un exemple comparatif...

NOMBRE DE MASSE ET NUMÉRO ATOMIQUE
Le nombre de masse représente la masse de l'atome qui est fonction de la quantité de nucléons (neutrons et protons). La masse est concentrée dans le noyau de l'atome.
Le numéro atomique représente la quantité d'électrons qui gravitent autour du noyau. C’est le nombre et l’arrangement des couches d’orbitales qui déterminent les propriétés électriques d’un atome, c’est-à-dire sa capacité à perdre ou à gagner des électrons dans la couche externe.
Le numéro atomique Z définit la quantité de charges électroniques dans un atome :
-
Z charges négatives des électrons
-
Z charges positives des protons.
Une même quantité de protons et d’électrons assure l’équilibre dans un atome : on dit alors qu’il est neutre.
Si un atome perd des électrons, il devient un cation, un ion positif.
Si un atome reçoit des électrons, il devient un anion, un ion négatif.

Tous les atomes qui ont un même nombre atomique ont les mêmes propriétés chimiques, même s'ils n'ont pas le même nombre de neutrons, ils appartiennent au même "élément" chimique.
On désigne les éléments par un symbole :
-
H = hydrogène
-
O = oxygène
-
C = carbone
-
Be = Béryllium
-
Au = or
-
Fe = fer
-
. . .
On décrit un élément sous cette forme :
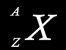
A : nombre de masse : corresponds au nombre total de protons et neutrons.
Z : numéro atomique ou nombre de charges correspond au nombre de protons et donc au nombre d'électrons si l'élément est électriquement neutre.
X : le symbole de l'élément.
Connaissant le nombre de masse et le nombre atomique, il suffit de soustraire l'un de l'autre pour connaître le nombre de neutrons.
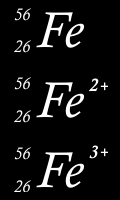
26 protons
30 neutrons
26 électrons
26 protons
30 neutrons
24 électrons
26 protons
30 neutrons
23 électrons
Il y a 94 éléments chimiques naturels dans l'univers connu, d'autres ont été synthétisés, le plus connu étant le plutonium.
80 ont au moins un isotope stable : tous ceux de numéro atomique inférieur ou égal à 82, sauf les 2 éléments :
43 Tc le Technétium qui est un métal de transition dont tous les isotopes sont radioactifs ;
61 Pm Prométhium (anciennement prométhéum puis promethium), un lanthanide est présent dans le milieu naturel à l'état de traces comme produit de fission spontanée de l'Uranium 238 et de désintégration α de l'Europium 151. (Ces deux sources entretiendraient respectivement une masse totale de prométhium naturel sur Terre de 560 g et 12 g. Il est notamment présent dans le minerai d'uranium à hauteur de 4 g pour 10 000 000 000 000 de tonnes de pechblende.)
Tous ces éléments ont été regroupés dans un "tableau périodique des éléments" dont l'origine remonte au grand chimiste Russe Dmitri Ivanovitch Mendeleïev qui en fit une première version en 1869, avec les 60 éléments connus à cette époque.

Classement alphabétique par numéro atomique...

Les éléments naturels radioactifs sont sur fond rouge, et
les éléments radioactifs de synthèse sur fond jaune orange.
Classement alphabétique des éléments ...

Classement alphabétique des symboles ...
Abondance des éléments dans la croûte et la lithosphère terrestre ...

Les abondances sont exprimées en PPM
ppm = partie par million : pour un kg 1ppm = 1 milligramme
10 000 PPM = 1/100 = 1%
Quelques données physiques des éléments présents dans la croûte terrestre ...

Les éléments marqués d'un * ont un point d'ébullition inférieur à 0°C,
Leur densité est exprimée en grammes par litre.


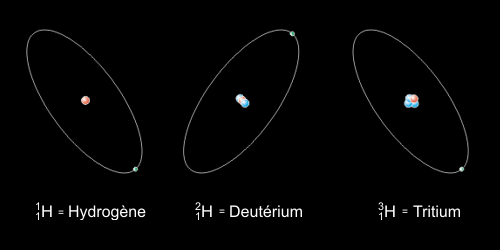
ISOTOPES
L'isotope est une variété d'un élément chimique qui comporte plus ou moins de neutrons que l'élément type. Comme il contient la même quantité de protons et d'électrons, il est électriquement neutre.
Les isotopes ont les mêmes propriétés chimiques, ils n'ont pas les mêmes propriétés physiques.
Par exemple, l’hydrogène contient un seul proton sans neutron, le deutérium a un proton et un neutron, tandis que le tritium possède un proton et trois neutrons.
Autre exemples...

Dans un article publié en décembre 1913 dans la revue Nature, le chimiste anglais Frederick Soddy (1877-1956) propose d'appeler « isotopes » les différentes variétés d'un élément chimique, car elles occupent la « même place » dans le tableau périodique de Mendeleïev. Depuis plusieurs années, Soddy enseigne à l'université de Glasgow en Écosse, après avoir servi de démonstrateur de chimie à l'université McGill de Montréal sous la direction d'Ernest Rutherford. Il étudie en détail la chimie des corps radioactifs transitoires obtenus lors de désintégrations, corps qu'il appelait avec Rutherford des « métabolons ». En 1911, il avait déjà noté que « l'identité complète de l'ionium, du thorium et du radiothorium » était si bien établie qu'il lui semblait inévitable de devoir conclure qu'on n'était pas en présence « de simples analogues chimiques, mais d'identités chimiques ». Ce n'était pas le seul cas observé, et Soddy notait aussi que le radium D, issu de la désintégration du radium, a toutes les caractéristiques chimiques du plomb. Il en conclut alors qu'il faut envisager le cas d'une « complète identité chimique entre des éléments de poids atomiques probablement différents », ce qui est en opposition apparente avec la table des éléments, qui les classe par ordre de poids atomiques croissants.
Soddy insiste également sur le fait que cette propriété n'est sans doute pas réservée aux éléments radioactifs ou à leurs produits de désintégration, même si elle apparaît plus simplement dans ce cas. Il se joint donc au chimiste William Crookes, qui, dès 1886, émit l’hypothèse que, même si la plupart des atomes de calcium ont un poids atomique de 40, certains sont représentés par 39 ou 41, un petit nombre par 38 et 42, et ainsi de suite. Soddy recevra le prix Nobel de chimie en 1921 « pour ses recherches sur l'origine et la nature des isotopes ».
Bernard PIRE
Écrit par :
-
Bernard PIRE : directeur de recherche au CNRS, centre de physique théorique de l'École polytechnique, Palaiseau
Source :
-
Universalis.fr


MENDELEÏEVE LE TABLEAU PÉRIODIQUE DES ÉLÉMENTS ...
Dmitri Ivanovitch Mendeleïev
Dmitri Ivanovitch Mendeleïev ou Mendeleev, chimiste russe, est né le 8 février 1834 à Tobolsk (Sibérie, Russie). Il est mort le 2 février 1907 à Saint-Pétersbourg (Russie).
Il est principalement connu pour son travail sur la classification périodique des éléments, publié en 1869 et également appelé tableau de Mendeleïev. Il déclara que les éléments chimiques pouvaient être arrangés selon un modèle qui permettait de prévoir les propriétés des éléments non encore découverts.
Mendeleïev était le cadet des nombreux enfants de Maria Dmitrievna Korniliev et Ivan Pavlovitch Mendeleïev (le treizième selon Michael Gordin 1, un historien des sciences). À l'âge de quatorze ans, après la mort de son père, Mendeleïev entre au lycée de Tobolsk. En 1849, la famille devenue pauvre s'installe à Saint-Pétersbourg, Dmitri entre à l'université en 1850. Après avoir reçu son diplôme, il contracta la tuberculose, ce qui l'obligea à se déplacer dans la péninsule criméenne près de la Mer Noire en 1855, où il devint responsable des sciences du lycée local. Il revint complètement guéri à Saint-Pétersbourg en 1856. Il étudia la chimie à Saint-Pétersbourg, où il fut diplômé en 1856. À 25 ans, il vint travailler à Heidelberg avec des savants comme Robert Bunsen et Gustav Kirchhoff. En 1867, il fut nommé professeur de chimie minérale à l'Université de Saint-Pétersbourg.
Entre 1859 et 1861, il travailla sur la densité des gaz à Paris, et au fonctionnement du spectroscope avec Gustav Kirchhoff à Heidelberg. En 1863, après son retour en Russie, il devint professeur de chimie à l'institut technologique et à l'université de Saint-Pétersbourg. La même année il épousa Feozva Nikitichna Leshcheva ; ce mariage se solda par un divorce. Il épousa ensuite Anna Ivanovna Popova.
En 1866, Newlands édita sa loi des octets. Mendeleïev avait travaillé sur une idée semblable, et le 6 mars 1869, une présentation formelle fut faite à la société russe de chimie, intitulée La dépendance entre les propriétés des masses atomiques des éléments, énonçant :
1. Les éléments, lorsqu'ils sont disposés selon leurs poids atomiques, montrent une périodicité apparente de leurs propriétés.
2. Les éléments qui sont semblables en ce qui concerne leurs propriétés chimiques ont des poids atomiques qui sont peu ou prou de la même valeur (par exemple Pt, Ir, Os) ou qui augmentent régulièrement (par exemple K, Rb, Cs).
3. L'arrangement des éléments, ou des groupes d'éléments dans l'ordre de leurs poids atomiques, correspond à leurs prétendues valences, aussi bien que, dans une certaine mesure, à leurs propriétés chimiques distinctives.
4. Les éléments qui sont le plus largement représentés ont de petits poids atomiques.
5. L'importance du poids atomique détermine le caractère de l'élément, de même que l'importance de la molécule détermine le caractère d'un corps composé.
6. Nous devons nous attendre à la découverte de nombreux éléments jusqu'ici inconnus. Par exemple des éléments analogues à l'aluminium et au silicium, dont la masse atomique serait comprise entre 65 et 75.
7. La masse atomique d'un élément peut parfois être modifiée par une connaissance de la masse de ses éléments contigus. Ainsi, le poids atomique du tellure doit se trouver entre 123 et 126, et ne peut pas être 128.
8. Certaines propriétés caractéristiques des éléments peuvent être prévues à partir de leur masse atomique.
Inconnu de Mendeleïev, Lothar Meyer travaillait à une classification périodique pratiquement identique bien qu'il ne soit jamais venu à l'idée de Meyer la possibilité de prévoir l'existence de nouveaux éléments et de corriger les masses atomiques. Meyer et Mendeleïev peuvent être considérés comme les cocréateurs de cette classification.
Bien que Mendeleïev ait été largement honoré par des organismes scientifiques à travers l'Europe, ses activités politiques ont inquiété le gouvernement russe, ce qui a mené à sa démission de l'université de Saint-Pétersbourg le 17 août 1890.
En 1893, il fut nommé directeur du bureau des poids et des mesures. Mendeleïev est également responsable de la justification scientifique de la proportion « optimale » de 40 % d'alcool dans la vodka russe.
En 1882, il reçut la Médaille Davy de la Royal Society, en 1889, le Prix Faraday de la Royal society of chemistry et en 1905 la médaille Copley de la Royal Society.
Il mourut à Saint-Pétersbourg où il est enterré au cimetière Volkovo.
L'élément 101 a été baptisé mendélévium en son honneur.
Sources :
Michael Gordin. 2004. A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table, Basic Books, ISBN 046502775X
Dmitri Ivanovitch Mendeleïev

Manuscrit, c'est le premier tableau de Mendeleïev,
conçu le 17 février 1869.
L'annotation en Français semble rajoutée.
C'est l'original conservé à Saint-Pétersbourg.
La légende retient une découverte en un seul jour de réflexion, le 17 février 1869. Mais en réalité, Mendeleïev a beaucoup tâtonné. Il hésite d’abord entre tableau et spirale pour retenir la forme actuelle qui lui permet de mieux souligner la périodicité.
Ci-dessous un copie retouchée pour une meilleure lisibilité.


Mise à jour 26-12-2023






